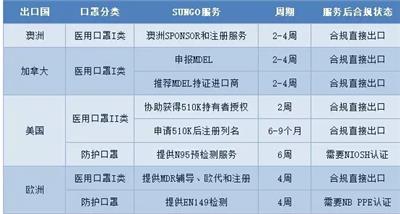
FDA510K技术文件要多久?
- 时间:2020-03-18作者:上海沙格企业管理咨询有限公司浏览:125
美国FDA510K和510(K) Exempt的区别
一、510K指的是FDA法规里面的一个章节,讲的是PMN,也就是Pre Market Notification 上市前通告。
510(k)文件是向FDA递交的上市前申请文件,目的是证明申请上市的器械与不受上市前批准(PMA)影响的合法上市器械同样安全有效,即为等价器械(substantially equivalent)。申请者必须把申请上市的器械与现在美国市场上一种或多种相似器械对比,得出并且支持等价器械的结论。合法上市器械是在1976年5月28日之前合法上市的器械(preamendment device),或者从III类器械中分入II或I类的器械,或者通过(510(k))程序发现与这样的器械等价的器械,或者通过自动的III 类器械定义的评价建立的器械。与之等价的器械被称为“predicate device(s)”。
二、医疗器械FDA认证流程
一类医疗器械,并且是豁免510K的产品,流程比较简单,只要申请企业注册和产品注册即可,没什么复杂的。
II类医疗器械,并且不豁免510K的产品,流程稍微复杂一点,首先要准备产品技术资料、产品工艺资料、产品参数资料、产品结构资料、产品测试数据等。有了这些资料,我们就可以撰写510K报告。撰写好510K报告,就要提交给FDA或第三方机构审核,审核通过后,就会取得一个510K代码,有了这个代码,就可以申请产品注册了,工厂注册随时可以申请。
大致流程就是:准备资料--撰写510K报告--510K报告提交机构审核--取得510K代码--产品注册和工厂注册--取得产品注册码和工厂注册码。
三、医疗器械FDA所需资料
对于I类豁免510K的医疗器械,做FDA注册相对比较简单,只要提供申请人信息(包括公司名称、地址、电话、联系人、邮箱、网站等)和产品英文名称即可,要是能多提供一些产品信息自然更好.
对于II类医疗器械,撰写FDA510K报告需要准备的资料比较多,大致的内容如下:
(1) 申请函,此部分应包括申请人(或联系人)和企业的基本信息、510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(K)号码;
(2) 目录,即510(K)文件中所含全部资料的清单(包括附件)
(3) 真实性保证声明,对此声明,FDA有一个标准的样本;
(4) 器材名称,即产品通用名、FDA分类名、产品贸易名;
(5) 注册号码,如企业在递交510(K)时已进行企业注册,则应给出注册信息,若未注册,也予注明;
(6) 分类,即产品的分类组、类别、管理号和产品代码;(7) 性能标准,产品所满足的强制性标准或自愿性标准;
(8) 产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
(9) 实质相等性比较(SE);
(10) 510(K)摘要或声明;
(11) 产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
(12) 产品的安全性与有效性,包括各种设计、测试资料;
(13) 常规测试项目: 生物相容性;产品性能。
(14) 色素添加剂(如适用);
(15) 软件验证(如适用);
(16) 灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。
四、FDA510K评审周期
Day 1:FDA receives 510(K) submission
↓
By Day 7
FDA sends Acknowledgement Letter.
OR
FDA sends Hold Letter if unresolved issues with User Fee and/or eCpoy.
↓
By Day 15:
FDA conducts Acceptance Review.
FDA informs submitter if 510(K) is accepted for Substantive Review or placed on RTA Hold.
↓
By Day 60:
FDA conducts Substantive Review.
FDA communicates via a Substantive Interaction to inform the sunmitter that the FDA will either proceed with Ineractive Review or that 510(K) will be placed on hold and Additional Information is required.
↓
By Day 90:
FDA sends final MDUFA Decision on 510(K).
↓
By Day 100:
If MDUFA Decision is not reached by Day 100,FDA Provides Missed MDUFA Decision Communication that identifines outstanding review issues
上海沙格企业管理咨询有限公司专注于MDRCE认证,FDA注册和FDA510K,欧盟自由销售证明,FDA验厂,CE临床评估报告,欧盟授权代表和欧盟注册等
词条
词条说明
今年2月1日,美国食品药品管理局(FDA)医疗器械与放射健康中心(CDRH)生物制品评估与研究中心发布了《基于安全性和基本性能的途径》指南文件。该指南旨在描述一个基于安全性和基本性能的可选途径,使510(k)提交者只需验证新器械符合FDA既定性能标准,就可以证明新器械具有与合法上市器械相当的安全性和有效性。对该指南文件进行研究探讨,有助于我们借鉴国际先进经验和工作方式,提高我国医疗器械的审评效率,
近年来,美国连续发生多起的污染事件,美国每年有4800**感染食源性疾病,每6个人就有一人因食品危害受到感染,**过10**住院,其中3000人死亡。2011年1月4日,美国*奥巴马签署了《FDA食品安全现代法案》,这是美国对《联邦食品药品化妆品安全法》的重大修订,根据现行法律,美国FDA有权对境外食品生产的厂家实施检查,以此提高供给美国的食品质量安全。二、检查要点1、检查接受的重要性美国FDA在
欧盟商标特点*。只须申请注册一次,即可在整个欧盟的二十七个成员国使用该商标。较之于在各个成员国分别提出申请,费用大幅度减少;保护程序集中化。一件商标注册可获得欧盟27个成员国的保护,有关商标案件的裁决将在欧盟所有的国家得到执行;已注册之商标可仅在一个欧盟国家使用。商标在欧盟任何一个国家的使用就足以对抗以未使用商标为由提出的撤销申请;享有巴黎公约**权。同一商标用于一种或多种*商品或服务名称,
过渡期结束后,不符合MDR要求的产品不可在欧盟上市至2020年5月26日,MDR法规将全面强制实施2019年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)较终提案发布新版MDR(REGULATIONEU2019/745)法规被弄得焦头烂额,这里要补,那里要加。几年前有一部很卖座的电影《无间道》里面提到一句话: 出来混迟早是要还的。临床评价的工作也是一样的,其实整个工作量是差
联系方式 联系我时,请告知来自八方资源网!
公司名: 上海沙格企业管理咨询有限公司
联系人: 袁阳
电 话: 021-80188750
手 机: 13472624604
微 信: 13472624604
地 址: 上海浦东金桥世纪大道1500号
邮 编:
相关推荐
相关阅读
1、本信息由八方资源网用户发布,八方资源网不介入任何交易过程,请自行甄别其真实性及合法性;
2、跟进信息之前,请仔细核验对方资质,所有预付定金或付款至个人账户的行为,均存在诈骗风险,请提高警惕!
- 联系方式
- 相关企业
- 广东亚检宏科检测有限公司
- 成都恒睿信安企业管理咨询有限公司
- 杭州临平企信商务服务工作室
- 罗普认证中心有限公司
- 傲天新盛(北京)科技有限公司
- 宁波华准检测技术有限公司
- 深圳世检检测有限公司
- 深圳市顺谨检测技术有限公司
- 天津市赛特检测有限公司
- 中标研国联(北京)认证中心
- 商家产品系列
- 产品推荐
- 资讯推荐

¥800.00



¥500.00



¥100.00

¥1.00

¥13000.00

电子后视镜陕汽Q/SQ 102084可靠性测试-专注汽车零部件DVP试验
¥99999.00