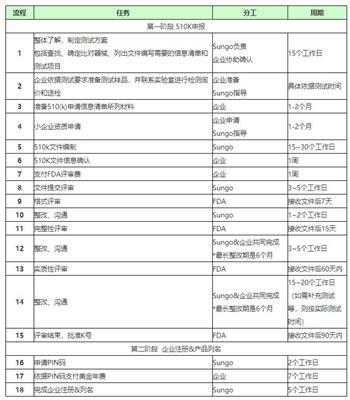
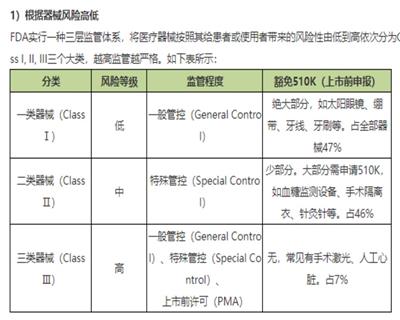
FDA验厂之辅导流程
- 时间:2021-09-13作者:上海沙格医疗科技有限公司武汉分公司浏览:32
FDA验厂的法规背景:
美国医疗器械监督管理局(FDA)是负责医疗器械管理的**机构。其根据各相关法律授权而**的各类法规性的文件编号为21CFRxxxx(xxxx为阿拉伯数字)。其中21CFR820是FDA根据法案*501,502,510,513,514,515,518,519,520,522,701,704,801,803条款的授权而**的规范医疗器械企业质量体系要求的法规,即Quality System Regulation,简称QSR或QSR820.
QSR820:
--又称21CFR820,是美国医疗器械质量管理体系法规的英文缩写,因其位于美国联邦法规(Code of Federal Regulations)*21卷*820部分,故名;
--QSR820是美国(人用)制造商以及拟将产品销往美国的外国(人用)制造商必须遵守的质量管理体系法规,是多数医疗器械在美国上市之前必须遵守、上市之后随时可能抽查的基本要求,这种抽查即通常所说的FDA医疗器械QSR820验厂
--符合性检查:无论谁(FDA,或第三方机构)对工厂实施检查,都只是一个(针对相关法规的)符合性检查,不颁发任何证书,不属于认证活动。
谁应该遵守QSR820?
21QSR820.1规定:所有在美国和波多黎哥境内的,或有产品出口到美国和波多黎哥境内的医疗器械企业,必须按QSR820的要求建立质量体系,企业可根据实际情况,满足QSR中与本企业制造活动相关的条款。
QSR820不适用
--不适用于医疗器械零件生产商,但鼓励这类企业以QSR820中适用的条款为指导;
--不适用于人血和血制品生产商,这类企业应遵循21CFR606的规定。
谁负责验厂
FDA下属的CDRH(器械与放射健康中心)是专职负责医疗器械企业管理的**机构,其根据FDA的授权,安排检查员到各企业进行工厂检查。
验厂抽查原则
--根据法律规定,对未豁免QSR 820的产品的生产企业,进行例行检查;(大多数情况)
--II类器械或有510(K)注册的器械的企业,*被抽到;
--为国外大公司做OEM的企业;
--产品在美国市场发生质量事故的企业。
检查频率及费用:
美国境内企业:一般每两年检查一次;
美国境外企业:不定期检查;
所有检查费用由FDA承担。
第三方机构代为审查:
在欧洲和美国本土,FDA也授权TUV等第三方机构进行工厂检查,委托企业需支付相应费用。这种委托第三方的检查只是个别的,仅适于FDA检查过并且无问题的企业,FDA对企业的**工厂检查不委托任何第三方进行。
验厂指南:
QSIT(质量体系检查技术)是FDA检查员的必修课程,也是FDA Quality Systems Inspection Reengineering Team专门编制的检查员手册,详细说明FDA审核员的检查方法、关注点。
验厂结果:
1.没有任何书面评价,这是较好的情况;
2.无批评的483表,或一封感谢信;
3.有批评的483表,它可能会导致:
1)Waring letter(警告信)
2)Seizure(查封)
3)Detention(扣押)
4)Restraining Orders and Injunctions(强制停产)
5)Penalties(罚款)
6)Recall(撤回)
审查**
1.评审文件(** or sampling)
2.QSIT方法(Quality System Inspection Technique)
4个主要子系统(Management, Design, CAPA, P&PC)
3个辅助子系统(Documentation, Material, and Facility & Equipment Controls)
3.抱怨和投诉
4.仓库
5.测量设备
6.卫生的特殊要求,
7.特殊过程,包括软件
8.设计变更:工程变更,材料更改
9.过程确认
上海沙格FDA验厂经验分享:
1.企业生产及出口美国的量越大,用户抱怨越多,被FDA查厂的可能性越大;
2.所有检查费用由FDA承担
3.FDA通常提前1-3个月通知验厂,但不会通知具体到厂日期;
4.通常FDA只来一个人,正常审核3-4天;
5.质量手册、程序文件等重要文件需翻译成英文,环境卫生要搞好;
6.FDA更强调内审及记录、相关部门的签字;
7.FDA非常重视法律法规、*知识、作业原则等员工培训与执行、签字;
8.如有不符合项,审核员会现场开出483表;
9.审核员提出的所有问题,企业必须在规定时间内提交书面回复,越快越好;
10.重大不符合项,审核员会现场开出警告信(Warning letter),企业须在规定时间内完成整改;
11.在此整改期间:
1)对国外厂商,所有产品到达美国海关将自动扣留
2)对美国厂商,FDA将通知其他**部门,以供其在采购招标时考虑
3)对美国厂商,FDA将暂停其办理出口的审批
12.如拒绝FDA验厂,或被发现与QSR 820严重不符项,工厂所有产品将被视为“假冒伪劣”
我们上海沙格能为您提供的服务:
一.差距分析
1:按Subpart A~O共15部分实施评审
2:现行组织机构、资源配置、质量体系文件、体系运行状况
3:运行的符合性、充分性、有效性
二.工作小组
1:管理者代表、小组成员构成
2:职责、分工
三.结构策划
1:确定文件结构
2:确定质量手册结构内容
3:确定程序文件的结构清单
4:确定采用的清单
5:确定作业书清单
6:确定上述文件接口
四.文件整合
1:质量手册整合
2:程序文件整合
3:表格整合
五.运行培训
1:QSR Subpart A~O共15部分讲解
2:QSR比ISO13485多出内容讲解
3:文件整合后培训、培训考核
六.辅导及整改
1:QSR运行、指导、纠正、完善
2:QSR管理职责、质量审查
3:QSR人员
4:QSR设计管理、文档管理、采购管理
5:QSR识别、追踪、生产和加工管理
6:QSR检查、测量、测试设备
7:QSR过程确认
8:QSR即将生产的、正在生产的、已完成产品的验收
9:QSR不合格产品、纠正和预防措施
10:QSR器械的标签、包装
11:QSR制造、储存、销售、安装、维修
12:QSR统计技术
七.记录检查
1:通用要求
2:记录:设备主记录、历史记录、质量体系记录、投诉记录
八.模拟审核
1:模拟审核策划、实施
2:编制不符合项报告表、模拟报告
3:不符合项原因分析
4:采取纠正措施、验正纠正措施
九.陪同审核
1:验厂注意事项
2:验厂经验、技巧
十.通过验厂
1:纠正措施计划、证据
2:QSR通过验收
上海沙格医疗科技有限公司武汉分公司专注于IVDR,CE认证,MDR,QSR820验厂,英国UKCA认证等
词条
词条说明
大家都知道,美国FDA测试标准对食品和药物开展管控和测试,美国是高度发达的我国,对食品接触材料的原材料及其制作工艺的需求都非常的严苛,大家日常生活中常常会使用到的不锈钢碗、塑料碗,进到美国销售市场以前都必须开展FDA测试,FDA测试对食品接触材料的测试标准十分严苛,针对不一样的商品实际实施的测试标准不一样,下边的時间大伙儿就和我们一起简易的掌握下FDA测试标准对食品级材料的测试全是根据哪些标准实
1.哪些企业需要关注UKCA的要求1)如果你有医疗器械产品销往英国市场2)如果你有医疗器械产品销往欧盟(英国以外),但是你之前的欧盟授权代表是在英国。2.如果你的医疗器械产品销往英国市场,你的应对之策包括:2.1如果是北爱尔兰市场1)继续实施CE认证,按照MDR和IVDR的要求实施;2)加贴CE标记;3)*欧盟授权代表或者英国法规责任人;4)完成产品的MHRA注册;5)产品上市销售。2.2.如果
(1)**决策ISO13485质量管理体系需要**者的决策,特别是较高管理者的决策。只有在较高管理者认识到建立ISO13485质量管理体系 必要性的基础上,组织才有可能在其决策下开展这方面的工作。另外,ISO13485质量管理体系的建立,需要资源的投入,这就需要较高管理者对改善组织的职业*卫生行爲做出承诺,从而使得ISO13485质量管理体系的实施与运行得到充足的资源。(2)成立工作组ISO13
很多人对于fda不是很了解,fda是美国食品药品监督管理局,美国本国生产以及进出口的相关产品,都要受到fda的监管,这也是在办理fda的时候所要掌握好的,在进行fda办理时,fda的标准需要了解清楚,那么fda标准指的是什么?如何测试?产品进行fda的认证,主要是根据fda的标准来进行的,根据fda的相关规定,进行fda的注册和检测,食品、药品、化妆品等在进行fda办理的时候需要进行fda的注册,
联系方式 联系我时,请告知来自八方资源网!
公司名: 上海沙格医疗科技有限公司武汉分公司
联系人: 蒋小姐
电 话: 17717017570
手 机: 18007141921
微 信: 18007141921
地 址: 湖北武汉江汉区新华西路武汉菱角湖万达广场A区A.幢A3单元12层5号
邮 编:
相关推荐
相关阅读
1、本信息由八方资源网用户发布,八方资源网不介入任何交易过程,请自行甄别其真实性及合法性;
2、跟进信息之前,请仔细核验对方资质,所有预付定金或付款至个人账户的行为,均存在诈骗风险,请提高警惕!
- 联系方式
公司名: 上海沙格医疗科技有限公司武汉分公司
联系人: 蒋小姐
手 机: 18007141921
电 话: 17717017570
地 址: 湖北武汉江汉区新华西路武汉菱角湖万达广场A区A.幢A3单元12层5号
邮 编:
- 相关企业
- 广东亚检宏科检测有限公司
- 成都恒睿信安企业管理咨询有限公司
- 杭州临平企信商务服务工作室
- 罗普认证中心有限公司
- 傲天新盛(北京)科技有限公司
- 宁波华准检测技术有限公司
- 深圳世检检测有限公司
- 深圳市顺谨检测技术有限公司
- 天津市赛特检测有限公司
- 中标研国联(北京)认证中心
- 商家产品系列
- 产品推荐
- 资讯推荐

¥800.00



¥500.00



¥100.00

¥1.00

¥13000.00

电子后视镜陕汽Q/SQ 102084可靠性测试-专注汽车零部件DVP试验
¥99999.00