什么是澳大利亚TGA认证?
- 时间:2021-12-15作者:上海角宿企业管理咨询有限公司浏览:315
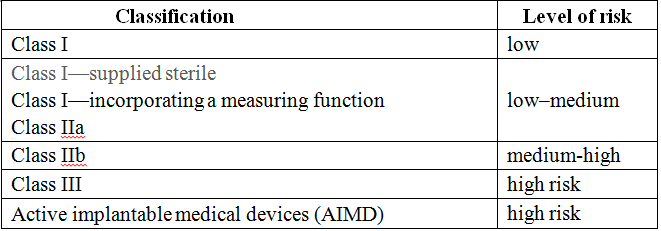
根据澳大利亚医疗用品法(Therapeutic Goods Act 1989)规定,所有在澳大利亚上市的医疗用品(药品和医疗器械)必须按有关要求,向澳大利亚医疗用品管理局(Therapeutic Goods Administration, TGA)提出注册或登记申请,获得注册登记(Australian Register of Therapeutic Goods,ARTG)后才能合法上市。澳大利亚把医疗器械分为I类、Is和Im、 IIa类、IIb类、III类、AIMD,产品的分类与欧盟分类类似。
上海角宿企业管理咨询有限公司专注于FDA510(K),N95认证,TGA注册,欧代注册,欧洲自由销售证明,MDR认证,ISO13485认证,SFDA注册,FDA注册等, 欢迎致电 17802157742
词条
词条说明
制造商必须先向药品和保健产品监管机构 (MHRA) 注册他们的设备,然后才能将其投放到英国市场。设备在注册前必须带有 CE 标志或 UKCA 标志。如果制造商不在英国,则其指定的英国负责人 (UKRP) 必须代表制造商注册设备。 注册过程:UKRP 任命证明,例如指定书或协议(**非英国制造商)制造商法定名称和地址设备符合的法规,例如,医疗设备指令 93/42/EECGMDN代
随着欧盟医疗器械法规(MDR)的实施,EUDAMED成为了MDR的关键点之一。作为一个全面的医疗器械数据库,EUDAMED将通过不同的系统模块收集和管理与医疗器械及相关公司有关的重要信息。EUDAMED(欧洲医疗器械数据库)覆盖整个欧盟,是欧盟评估欧盟市场上的经济运营商和医疗器械的最佳工具。然而,EUDAMED 目前尚未完全发挥作用。EUDAMED 平台由六个相互关联的模块组成,用于提交以下数据:
人们对“永远年轻”的追求,**了医疗美容行业的快速发展,医疗美容类医疗器械的使用逐年上升,医疗美容医疗器械生产企业、销售企业以及医疗机构的合法合规经营也受到药监局的重点监管。本文将介绍一下医美器械的生产注册要点。1、医疗美容相关概念1)医疗美容机构医疗美容机构是指以开展医疗美容诊疗业务为主的医疗机构,包括医疗美容诊所、医疗美容门诊部、整形医院。医疗美容机构开展的美容项目主要包括:美容皮肤科、美容外
为什么需要欧洲授权代表?如果您是在欧盟没有注册办事处的医疗器械或 IVD 制造商,则必需指定当地的欧洲授权代表 (EU AR/EAR) 以满足欧盟 MDR 或 IVDR 的要求。上海角宿团队可以提供此服务。欧洲授权代表也可称为 EAR、EU AR、EC REP、CE REP 或 EU REP。作为您的欧洲授权代表,角宿可以提供哪些服务? 我们将:对您的 CE 技术文件进行完
联系方式 联系我时,请告知来自八方资源网!
公司名: 上海角宿企业管理咨询有限公司
联系人: 杨经理
电 话:
手 机: 17802157742
微 信: 17802157742
地 址: 上海浦东申港申港大道133号609
邮 编:
网 址: bys0613.b2b168.com
相关推荐
相关阅读
1、本信息由八方资源网用户发布,八方资源网不介入任何交易过程,请自行甄别其真实性及合法性;
2、跟进信息之前,请仔细核验对方资质,所有预付定金或付款至个人账户的行为,均存在诈骗风险,请提高警惕!
- 联系方式
公司名: 上海角宿企业管理咨询有限公司
联系人: 杨经理
手 机: 17802157742
电 话:
地 址: 上海浦东申港申港大道133号609
邮 编:
网 址: bys0613.b2b168.com
- 相关企业
- 江苏凡睿管理咨询有限公司
- 湖北华思企业管理有限公司
- 北京宏易管理咨询有限公司
- 重庆博视知识产权服务有限公司
- 青岛刘小帮企业管理咨询有限公司
- 广西英达思企业管理咨询有限公司
- 河南省新起点企业管理咨询有限公司
- 成都遇上良缘婚姻服务有限公司
- 广东励信知识产权服务有限公司
- 广东华智天诚管理顾问有限公司
- 商家产品系列
- 产品推荐
- 资讯推荐


¥1000.00


¥500.00



血压计FDA器械注册的测试标准-SPICA INSIGHTS
¥30000.00

¥2000.00






















