什么是510(k)第三方审核计划和第三方紧急使用授权(EUA)审核
- 时间:2024-02-22作者:上海角宿企业管理咨询有限公司浏览:39
2023年年末,FDA发布了“510(k) Third Party Review Program and Third Party Emergency Use “510(k)第三方审核计划和第三方紧急使用授权(EUA)审核指南草案。
该草案概述了FDA目前对510(k)第三方审核计划和紧急使用授权(EUA)请求的关键想法,描述了FDA对第三方审核510(k)提交和第三方审核组织对EUA请求的期望,并提供了有关510(k)第三方审核计划的最新建议。相关内容曾在 2020 年最终指南“510(k) Third Party Review Program ”510(k)第三方审核计划中讨论过。
相较于之前发布的最终指南,本次更新主要增添了对510(K)第三方审核计划和EUA第三方审核之前的描述及区分等内容。
01什么是510(K)第三方审核
510(k)第三方审核计划是一种自愿的医疗器械替代审核流程,即允许经认可的第三方审核组织(3P 510k审核组织)审核某些中低风险的医疗器械。
该计划旨在加快中低风险器械510(k)审核速度,让FDA可以将资源集中在高风险器械的审核上,但FDA仍保持对符合第三方审核资格的中低风险器械的审核监督权限。
FDA第三方510(k)审核基本流程图如下:
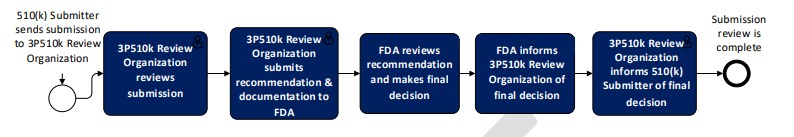 按上图所示,510(k)申请人首先向510(k)第三方审核机构递交技术文件,第三方审核机构按照与FDA相同的标准审核完成后向FDA递交推荐意见,FDA审核之后做出最终决定并通知第三方审核机构,第三方审核机构将最终结果通知申请人。
按上图所示,510(k)申请人首先向510(k)第三方审核机构递交技术文件,第三方审核机构按照与FDA相同的标准审核完成后向FDA递交推荐意见,FDA审核之后做出最终决定并通知第三方审核机构,第三方审核机构将最终结果通知申请人。02什么是EUA第三方审核
在本指南中,FDA除了提到510(K)第三方审核机构,还提到了EUA第三方审核。该机构旨在支持FDA保护和促进公众健康的使命,使该机构能够“激增”或*扩大其审核资源,用于审核与医疗器械相关的EUA请求。
根据《联邦食品、药品和化妆品法》*564条,FDA可在卫生与公众服务部长(HHS)发布紧急情况或威胁声明,证明授权紧急使用是正当的(“EUA声明”)后,授权在某些紧急情况下紧急使用未经批准的产品。

03哪些器械可申请510(K)第三方审核
目前,符合510(K)第三方审核路径审核要求的器械主要包括 I 类及部分 II 类器械,高风险III类及较为复杂的II类器械不在510(k)第三方审核机构的审核范围内。
FDA会动态更新产品列表,使FDA始终可将审查资源集中于高风险及复杂器械,同时保持对第三方审核项目的高度信任,现如今涵盖的器械大类如下:

在向510(K)第三方审核机构提出申请之前,制造商应先浏览FDA官网上的第三方审核的器械清单及不同第三方审核机构所能审核的器械目录。
04哪些机构510(K)第三方审核资质
根据《联邦食品、药品和化妆品法》*523条,当经认可的第三方实质上不符合相关规定时,FDA可以在提供通知后暂停或撤销对任何第三方审查组织的认可。
上海角宿企业管理咨询有限公司专注于FDA510(K),N95认证,TGA注册,欧代注册,欧洲自由销售证明,MDR认证,ISO13485认证,SFDA注册,FDA注册等, 欢迎致电 17802157742
词条
词条说明
CE认证是欧盟为**公共安全和健康、保护环境等方面,而制定的一系列法规要求和测试要求。如果您想在欧洲市场销售产品,那么您需要办理CE认证。那么CE认证多久能办理完成?需要多少钱?这问题并不好回答,因为CE认证的费用和周期因为产品类型、测试方法和标准等因素会有所差异。以下是不同的CE认证指令大概需要的费用和周期:1. 低压指令LVD(Low Voltage Direct
当您不再持有足够的证据时TGA要求:当您没有或无法保持足够的安全和性能证据时(例如,关于以前无法预见的危险的新证据变得可用),您必须修改您的预期目的以缩小范围,修改您的使用说明等。如果您发现您的设备存在重大且不可接受的安全问题,您必须停止供应、进行召回或将您的设备从 ARTG 中移除。您可以持有的证据类型您可以使用一系列数据作为客观证据来表明您的设备符合这些原则。下面的列表包括一些建议。请注意,此
流程:1.根据客户产品以及FDA相关法规,指导原则**510(k)申请信息清单。2.根据客户提供的初步材料,例如说明书,产品手册等,及产品的特点选定对比产品3.准备测试样品。4.申请DUNS编号5.测试准备工作,联系检测机构,获取报价,说明检测项目和检测要求等。6.准备510(k)申请信息清单所列材料。7.产品测试,由实验室对产品进行测试。8.编写510(k)文件,并向FDA递交文件9.FDA受理
沙特的SFDA、SASO、Sabre和FASAH有什么区别和关系?
1. 沙特食品药品管理局(SFDA):沙特食品药品管理局成立于2003年,是负责监管食品、药品、医疗器械、化妆品、农药和饲料安全的国家机构。SFDA的目标是通过法规和有效控制保护社会,确保相关产品的质量和安全。如果产品属于SFDA的管辖范围,那么它需要符合其规定的质量控制和包装等法规。SFDA运营着自己的在线门户网站,进口商可以通过该门户网站输入制造商信息并上传相关文件,以便SFDA确认安全和质量
联系方式 联系我时,请告知来自八方资源网!
公司名: 上海角宿企业管理咨询有限公司
联系人: 杨经理
电 话:
手 机: 17802157742
微 信: 17802157742
地 址: 上海浦东申港申港大道133号609
邮 编:
网 址: bys0613.b2b168.com
相关推荐
相关阅读
1、本信息由八方资源网用户发布,八方资源网不介入任何交易过程,请自行甄别其真实性及合法性;
2、跟进信息之前,请仔细核验对方资质,所有预付定金或付款至个人账户的行为,均存在诈骗风险,请提高警惕!
- 联系方式
公司名: 上海角宿企业管理咨询有限公司
联系人: 杨经理
手 机: 17802157742
电 话:
地 址: 上海浦东申港申港大道133号609
邮 编:
网 址: bys0613.b2b168.com
- 相关企业
- 江苏凡睿管理咨询有限公司
- 湖北华思企业管理有限公司
- 北京宏易管理咨询有限公司
- 重庆博视知识产权服务有限公司
- 青岛刘小帮企业管理咨询有限公司
- 广西英达思企业管理咨询有限公司
- 河南省新起点企业管理咨询有限公司
- 成都遇上良缘婚姻服务有限公司
- 广东励信知识产权服务有限公司
- 广东华智天诚管理顾问有限公司
- 商家产品系列
- 产品推荐
- 资讯推荐


¥1000.00


¥500.00



血压计FDA器械注册的测试标准-SPICA INSIGHTS
¥30000.00

¥2000.00























